Sandra Acosta: “Los organoides cerebrales suponen un salto importante para avanzar en la comprensión de la progresión del Alzheimer”.
Excelente divulgadora, y con una larga experiencia, Sandra Acosta detalla el extenso trabajo que se está realizando en la Fundación Pasqual Maragall para comprender mucho más a fondo los mecanismos que intervienen en el avance de la enfermedad de Alzheimer. Como líder, desde el pasado mes de abril, del nuevo grupo creado (Grupo de Investigación en Modelos de Enfermedades Neurológicas, uno de los 6 de los que dispone el Barcelonaβeta Brain Research Center, BBRC), focaliza su trabajo en organoides, pequeños órganos confeccionados a partir de células madre de personas. Investiga con estos ingenios biológicos desde hace más de quince años, lo que la hace ser referencia y coordinadora ideal de este equipo que debe ayudar a entender más detalladamente cómo avanza, y cómo podría prevenirse, una demencia que actualmente sufren más de 100.000 mujeres y hombres diagnosticados en Cataluña.

Licenciada en biología (2004) y doctora en biología molecular y celular por la Universidad de Barcelona (2009) Sandra Acosta ha recorrido mundo y se ha centrado en el neurodesarrollo y en estudiar el cerebro humano en condiciones sanas y frente a enfermedades como la epilepsia o el Alzheimer. Ejerce de profesora Serra Hunter de neuroanatomía, desde el año 2021 en Patología y Terapéutica Experimental en la Facultad de Medicina de la UB, ubicada en el Campus de Bellvitge y es investigadora principal de neurogenómica funcional. Entró en contacto con el Alzheimer hace unos cinco años, a raíz de sus conversaciones con el doctor Arcadi Navarro, director de la Fundación Pasqual Maragall desde el 2019, y ahora inicia nueva etapa al frente de su centro de referencia para la investigación (BBRC).
A principios de este año se creó en el Barcelonaβeta Brain Research Center un nuevo grupo, que se suma de esta forma a los 5 otros ya existentes: investigación en modelos de enfermedades neurológicas. Explícanos cómo surge y cómo funciona.
Se trata de un nuevo grupo que se creó en el mes de abril. Se abrió, meses antes, un largo proceso de selección, me presenté y al final me eligieron, seguramente por mi trayectoria en el campo de los organoides, donde no hay muchos especialistas. El equipo incluye parte del grupo que ya trabaja en la UB y a doctorandos, y contribuye a la gran red dentro del BBRC. Tenemos 3 laboratorios: el de la universidad, el del Barcelonaβeta Brain de la sede de la Fundación, y el que existe en las instalaciones del Parc de Recerca Biomèdica, que incorpora microscopios avanzados y con mucha más definición. También tenemos una pequeña rama para estudiar enfermedades neurológicas pediátricas en Sant Joan de Déu. Como principales tareas consolidamos el seguimiento de la evolución del Alzheimer y también de la epilepsia, en fases de progresión, no iniciales. Buscamos comprender aquellos cambios que se producen a nivel molecular con la investigación y también con datos de pacientes y voluntarios.
Todo esto enmarcado en el proyecto de organoides cerebrales que ya lleva tres años funcionando. ¿Cómo nació y cuál ha sido la evolución?
El trabajo con miniórganos u organoides marca un gran punto de inflexión de cara a la investigación. Su impulso viene de fuentes de financiación y posibilidades de ampliación, que coinciden con un progresivo auge de estos modelos que se consolidan poco a poco. Proporcionan nuevos datos más precisos, que se suman a los demás que se obtienen de estudios experimentales para conformar un marco más robusto. Durante todo este período los cinco grupos que existían antes que el nuestro dentro del BBRC han ido creciendo e incorporando, en algún caso, a los organoides. Pero faltaba un equipo más especialista, y por eso estamos aquí.
Para aquel que no lo conozca, ¿explícanos que es un organoide y cómo se crea un organoide cerebral?
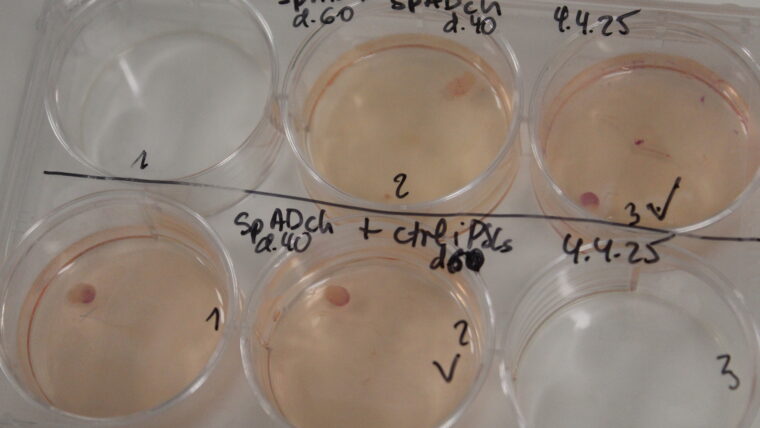
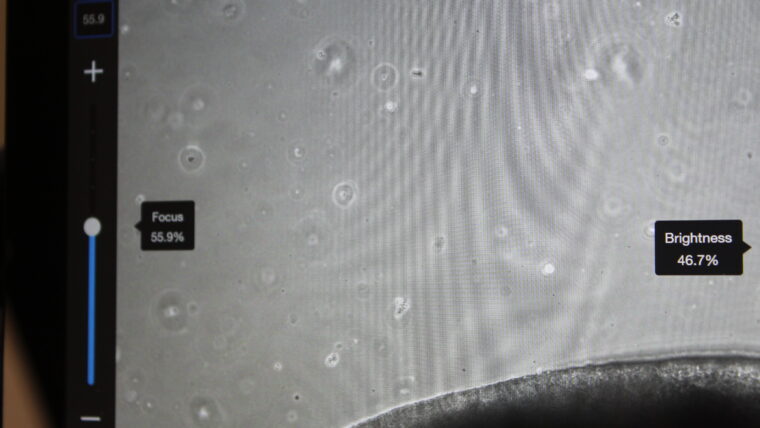
Son órganos en miniatura, que miden pocos milímetros de grosor. Popularmente se llaman “minicerebros” pero no son tales porque no van unidos a un cuerpo ni tienen toda su complejidad. El proceso de creación está muy estandarizado. Se utilizan células madre (las que pueden diferenciarse en otros tipos celulares) que provienen del amplio banco que dispone el BBRC de varios modelos humanos (extraídas a partir de biopsias o bien de donantes de sangre). Éstas se reprograman, añadiéndoles genes concretos, para devolverlas a su estadio embrionario y transformarlas en células madre pluripotentes inducidas, que pueden convertirse ya en cualquier tipo celular. Ciertas de ellas se congelan, para estar a disposición más adelante, y otras pasan a los cultivos en los que se les administran nutrientes, que ya están muy determinados, y en unos pocos meses generan los miniórganos, en este caso de cerebro.
Más o menos un 30% puede salir defectuoso, no bien formado, o dañarse si se transporta. Es por ello que vamos creando constantemente para garantizar que siempre estén a disposición tanto para nosotros como para nuestros colaboradores, como el grupo que investiga los efectos de la COVID dentro del Hospital de Can Ruti. Actualmente, tenemos unos 800 organoides disponibles de cerebro que se conservan en condiciones muy controladas. Tienen que estar dentro de una estufa, un recipiente que es hermético y se mantiene a 37 grados (la temperatura en el cuerpo humano) e incorpora, de forma continuada, un 5% de dióxido de carbono, para mantener la acidez de la mezcla.
En estas estructuras se observan diferentes procesos que al final deben conducir a facilitar nuevas terapias y a prevenir la enfermedad de Alzheimer. ¿Cómo trabajáis exactamente?
Nos centramos en comprender la progresión de la afectación cuando avanza, más allá de una pura fase inicial. Se examinan muchos procesos y se comparan para extraer determinadas conclusiones. Sobre todo se observan los bioindicadores, ciertos cambios moleculares que se asocian con esta enfermedad, como son los amiloides (agregados de proteínas), o la proteína Tau (muy abundante en el sistema nervioso central). Y miramos las moléculas de ARN (o ácido ribonucleico, el que transcribe la información proporcionada por el ADN) para definir alteraciones y también genes que predisponen a sufrir la enfermedad. Por otro lado, unimos a dos organoides, uno sano y uno con Alzheimer y vemos si uno traspasa hacia el otro, o les inducimos el SARS-COV-2 para observar cómo evoluciona este virus en los casos de demencia.
En cada paso es importante contar qué ocurre con las sinapsis, las conexiones neuronales que, cuando se rompen, pueden dañar áreas extensas del cerebro y producir cascadas tóxicas, como la neuroinflamación.
¿Pueden también conservarse congelados los organoides cerebrales?
A diferencia de otros muchos organoides, que sí pueden conservarse en estado de congelación para permanecer a disposición cuando se precisen, los miniórganos de cerebro son muy sensibles, y por tanto es imposible congelarlos. Es una auténtica pena, porque ahorraría costes y cierto tiempo en la investigación, pero es totalmente imposible, a día de hoy, no estropear las neuronas y debemos ir fabricando.
Se ha insistido últimamente en recaudar financiación para continuar con este trabajo. La campaña “Minicervells per pensar en gran”, cuyas donaciones se destinarán al estudio centrado en el desarrollo de cerebros miniatura a partir de células madre para explorar la aparición y progresión del Alzheimer, concluyó en enero y alcanzó 312.820 euros. Un éxito porque es más de lo que os fijábais…
Rotundo! La investigación necesita mucho dinero y si no fuera por los muchos donantes y estas campañas puntuales nosotros no podríamos estar aquí. Sólo para crear, para que os podáis hacer una idea, estos 800 organoides que tenemos se necesitan 6.000 euros. Y un microscopio avanzado como el que hay en el Parc de Recerca Biomèdica, con muy alta definición, unos 500.000. Si no fuera por las ayudas de la gente, todo esto no sería posible.
Hasta hace poco la investigación en enfermedades neurodegenerativas se basaba meramente en animales (básicamente en primates o ratones). ¿Qué cambia, aparte de la ética y científicamente hablando, con ese nuevo método in vitro?
Pues ganamos en precisión y muchas posibilidades porque no tenemos que considerar las restricciones tanto normativas como morales de trabajar con un ser vivo. En primer lugar, un ratón no puede sufrir la enfermedad del Alzheimer, y por tanto los resultados que se obtengan no serán extrapolables a lo que ocurre en las personas. El organoide, por otra parte, es humano, y aunque no sea tan completo como un cerebro es una herramienta relevante para la investigación que nos abre muchos nuevos caminos y nos proporciona un detalle mucho más completo.
Las pruebas en ratones nos ayudan a entender cómo evoluciona su sistema neuronal en caso de cualquier tipo de enfermedad (infecciosa, degenerativa, inflamatoria, o incluso metabólica), y a relacionar estos registros con el resto de medidas. Al final tenemos un mapa en el que contribuyen muchas piezas (organoides, seguimiento de voluntarios, aplicación en pacientes o bancos de datos de personas y animales) para relacionarlas y extraer conclusiones.
Habláis de cambiar la investigación para terapias, y de avanzar en un concepto que progresa: la medicina personalizada. ¿Cómo la promovéis vosotros y dónde nos encontramos en este campo?
De momento diferenciamos a los organoides en ciertos grupos, según provengan de una persona u otra, porque todos nos comportamos de una forma particular ante las afectaciones. Todo esto con la evolución nos puede conducir a crear patrones de miniórganos, que serán mucho más fieles a determinadas personas. Y en poco tiempo esto puede llevar a investigar directamente y de forma mucho más precisa la evolución o ciertos remedios para pacientes individuales.
Desde el pasado 2013, el Barcelonaβeta Brain Research Center lleva adelante el proyecto Alfa Cognición, que desde el año 2017 cuenta con la financiación del Ayuntamiento de Barcelona. Cuéntanos en qué consiste.
Es precisamente uno de los proyectos que añaden datos básicos para poder comprender mejor la enfermedad de Alzheimer. Se ofrecen voluntarios, entre los 45 y 75 años de edad, la mayoría descendientes de pacientes que han sufrido Alzheimer. A través de foto imagen y otras pruebas se sigue la evolución de las neuronas (algo que es muy relevante porque se trata de cerebros reales). Se controlan también los factores genéticos, la evolución de proteínas y otros indicadores. Todo esto a largo plazo proporciona conclusiones, como por ejemplo, que no todos los descendientes genéticamente dispuestos a contraer la enfermedad terminan desarrollándola. Y enlaza con el trabajo que realizan otros grupos que identifican la eficacia de conductas naturales (una buena alimentación, ejercicio físico o práctica intelectual) para prevenir la afectación.
Estos estudios continuarán en el tiempo hasta obtener muchos más datos y una serie más longeva y más robusta.
Por otra parte, el pasado mes de diciembre, el Ayuntamiento firmaba un convenio para impulsar el Hub Alzheimer Barcelona. Participarán también el Hospital de Sant Pau, el Hospital Clínic de Barcelona, el Hospital del Mar y el Hospital Universitari Vall d’Hebron. ¿Cómo valoras esta nueva iniciativa?
Es importante por dos motivos. Para reforzar todo el ámbito de la investigación en la ciudad (colaborar aún más estrechamente y ampliar el alcance de todo lo que se investiga) y para captar financiación. La ciudad, de esta forma, se presenta como un hub líder, y hace más fácil atraer tanto nuevo talento como nuevo dinero desde el estado o desde Europa. Y además se abren nuevas becas para seguir investigaciones, doctorado o fases postdoctorales.
En general, ¿cuáles consideras que han sido los avances más destacados de este proyecto y qué se espera para el futuro? ¿Será posible prevenir y tener un remedio para el Alzheimer?
Hemos podido avanzar mucho y hemos creado herramientas innovadoras, como lo son los organoides de cerebro, pero sólo estamos en los inicios de la comprensión total de esta neurodegeneración mayoritaria. Van surgiendo otras hipótesis y tenemos ciertas conclusiones pero hay que progresar aún más para entender todos los procesos y después posteriormente investigar con nuevos remedios.
Todo va muy acelerado y se están volcando muchos esfuerzos. En poco tiempo se espera que se avance bastante, pero por ahora es imposible decir en qué grado y mucho menos determinar cuándo será factible prevenir o curar el Alzheimer (en las fases importantes, las que ya van mucho más allá de simples lapsus iniciales y conllevan graves consecuencias). Sin embargo, es evidente que estamos mejor que hace veinte años y hay esperanza y resultados prometedores.